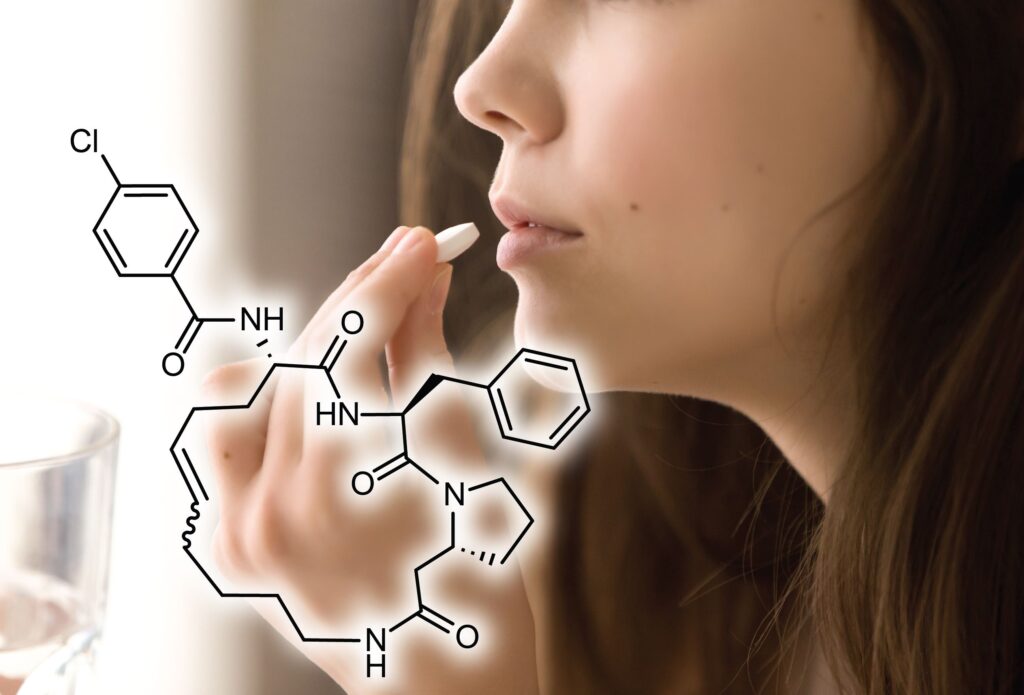
Forschende an der EPFL haben stabile zyklische Peptide entwickelt, die eine viel höhere orale Bioverfügbarkeit aufweisen als herkömmliche Peptide. Mit der Methode könnte eine neue Generation von oralen Medikamenten für bisher unbehandelbare Krankheiten hervorgebracht werden.
Seit Jahrzehnten sind viele Proteine, die für die Behandlung verschiedener Krankheiten von entscheidender Bedeutung sind, für orale Arzneimitteltherapien nicht zugänglich. Herkömmliche kleine Moleküle haben oft Schwierigkeiten an Proteine mit flachen Oberflächen zu binden oder haben eine zu geringe Spezifität. Grössere Antikörper-Therapeutika, die an diese Proteine gut und spezifisch binden können, müssen in der Regel injiziert werden, was die Patientenfreundlichkeit und Zugänglichkeit einschränkt.
Mit einer neuen Studie, die in der Fachzeitschrift Nature Chemical Biology veröffentlicht wurde, haben Forschende im Labor von Prof. Christian Heinis an der EPFL einen Meilenstein in der Arzneimittelentwicklung erreicht. Dieser öffnet die Tür zu einer neuen Klasse von oral verfügbaren Medikamenten und löst damit ein langjähriges Problem der Pharmaindustrie.
«Es gibt viele Krankheiten, für die zwar die Targets identifiziert wurden, aber für die keine Medikamente entwickelt werden konnten, welche diese Targets binden und erreichen», sagt Heinis. «Eine grosse Anzahl von ihnen sind Krebsarten, und viele Ziele in diesen Krebsarten sind Protein-Protein-Interaktionen, die für das Tumorwachstum wichtig sind, aber nicht gehemmt werden können.»

Die Entwicklung zyklischer Peptide als orale Arzneimittel hat sich als schwierig erwiesen, da diese schnell verdaut oder vom Magen-Darm-Trakt schlecht aufgenommen werden. «Zyklische Peptide sind für die Arzneimittelentwicklung von grossem Interesse, da diese Moleküle an schwierige Zielstrukturen binden können, was mit herkömmlichen kleinen Molekülen nur schwer zu erreichen ist», erklärt Heinis. «Doch die zyklischen Peptide können in der Regel nicht oral, als Pille, verabreicht werden, und das schränkt ihr Anwendungsfeld enorm ein.»
Zyklischer Durchbruch
Die Studie konzentrierte sich auf zyklische Peptide, die als vielseitige Moleküle für ihre hohe Affinität und Spezifität bei der Bindung an anspruchsvolle Krankheitsziele bekannt sind. Ins Visier nahm die Forschungsgruppe das Enzym Thrombin, das aufgrund seiner zentralen Rolle bei der Blutgerinnung ein kritisches Krankheitsziel darstellt. Die Regulierung von Thrombin ist der Schlüssel zur Vorbeugung und Behandlung thrombotischer Erkrankungen wie Schlaganfälle und Herzinfarkte.
Um zyklische Peptide zu erzeugen, die gegen Thrombin gerichtet und ausreichend stabil sind, entwickelten die Forschenden eine kombinatorische Synthesestrategie. Mit dieser konnten sie grosse Bibliotheken mit verschiedenen zyklischen Peptiden herstellen, um anschliessend jene mit ausreichender Bindungsstärke, Stabilität und Membrandurchlässigkeit zu identifizieren.
«Es ist uns nun gelungen, zyklische Peptide zu erzeugen, die an ein Krankheitsziel unserer Wahl binden und auch oral verabreicht werden können», sagt Heinis. «Dazu haben wir eine neue Methode entwickelt, bei der Tausende von kleinen zyklischen Peptiden mit zufälligen Sequenzen im Nanomassstab chemisch synthetisiert und in einem Hochdurchsatzverfahren untersucht werden.»
Zwei Schritte, ein Topf
Das neue Verfahren besteht aus zwei Schritten und findet im gleichen reaktiven Behälter statt – von Chemikern auch als «One Pot» bezeichnet. Im ersten Schritt werden lineare Peptide synthetisiert, die dann in einem chemischen Prozess eine ringförmige Struktur bilden, also «zyklisiert» werden. Um stabile Thioether-Bindungen zu bilden, werden «bis-elektrophile Linker» verwendet, also chemische Verbindungen, die zwei Molekülgruppen miteinander verbinden.
In der zweiten Phase werden die zyklisierten Peptide einer Acylierung unterzogen, einem Prozess, bei dem Carbonsäuren an sie angehängt werden, wodurch sich ihre Molekularstruktur weiter verändert. Diese Technik macht Zwischenreinigungsschritte überflüssig und ermöglicht ein Hochdurchsatz-Screening direkt in den Screening-Platten. Dabei werden die Synthese und das Screening tausender Peptide kombiniert, um Kandidaten mit hoher Affinität für bestimmte Krankheitsziele – in diesem Fall Thrombin – zu identifizieren.
Mit dieser Methode hat Manuel Merz, Doktorand an der EPFL, eine umfassende Bibliothek von 8448 zyklischen Peptiden mit einer durchschnittlichen Molekülmasse von etwa 650 Dalton erstellt, die nur wenig über der für oral verfügbare kleine Moleküle empfohlenen Höchstgrenze von 500 Dalton liegt. Die zyklischen Peptide zeigten auch eine hohe Affinität für Thrombin.
Bei Tests an Ratten wiesen die Peptide eine orale Bioverfügbarkeit von bis zu 18 Prozent auf. Das heisst, wenn das zyklische Peptidmedikament oral eingenommen wird, gelangen 18 Prozent davon erfolgreich in den Blutkreislauf, sodass eine therapeutische Wirkung erzielt werden kann.
Mehr als eine Million Moleküle
Die orale Verfügbarkeit zyklischer Peptide eröffnet Möglichkeiten zur Behandlung diverser Krankheiten, die mit herkömmlichen oralen Medikamenten nur schwer zu behandeln sind. Die vielseitige Methode kann an eine breite Palette von Proteinen angepasst werden, was zu einem Durchbruch in jenen Bereichen führen könnte, in denen der medizinische Bedarf derzeit nicht gedeckt ist.
«Um die Methode auf anspruchsvollere Krankheitsziele wie Protein-Protein-Interaktionen anzuwenden, müssen wahrscheinlich grössere Bibliotheken synthetisiert und untersucht werden», ergänzt Merz. «Durch die Automatisierung weiterer Schritte der Methode scheinen neue Bibliotheken mit mehr als einer Million Molekülen in Reichweite zu sein.»
EPFL-Spin-off erhält 26 Millionen Euro
Die von Prof. Christian Heinis und Sevan Habeshian an der EPFL entwickelte Technologie für die Herstellung von oral verfügbaren zyklischen Peptiden wird vom EPFL-Spin-off Orbis Medicines, das orale makrozyklische Arzneimittel erforscht, kommerziell genutzt. Das Lausanner Unternehmen hat Ende Februar den Start einer 26-Millionen-Euro-Finanzierung bekanntgegeben für die Erweiterung und Weiterentwicklung makrozyklischer Arzneimittel, sogenannte «nCycles». Makrozyklen sind eine grosse und vielfältige Familie von Verbindungen mit wünschenswerten therapeutischen Eigenschaften, die durch das Vorhandensein einer zyklischen Struktur definiert sind. Die nCycles werden so entwickelt, sodass sie oral bioverfügbar und membrandurchlässig sind.
ChemieXtra
In einem nächsten Projektschritt nehmen die Forschenden mehrere intrazelluläre Protein-Protein-Interaktionsziele ins Visier, für die es bisher schwierig war, Hemmstoffe auf der Basis klassischer kleiner Moleküle zu entwickeln. An der EPFL ist man zuversichtlich, dass zumindest für einige von ihnen oral anwendbare zyklische Peptide entwickelt werden können.
Nik Papageorgiou, EPFL