Wie kann die Wirkung eines neuen Medikaments erforscht werden? Wie kann das Zusammenspiel verschiedener Organe besser verstanden werden? Forschende haben eine neue Methode entwickelt, Blutgefässe in winzigen Organmodellen auf einem Chip zu erzeugen – rasch und reproduzierbar.
In der medizinischen Forschung spielen sogenannte «Organ-on-a-Chip»-Anwendungen (auch mikrophysiologische Systeme genannt) eine wachsende Rolle: Wenn man es schafft, Gewebestrukturen in Labor auf präzise kontrollierbaren Chips wachsen zu lassen, dann kann man viel präziser forschen als das mit Versuchen an lebenden Menschen oder Tieren möglich wäre.
Allerdings stösst man dabei auf ein grosses Problem: Solche Mini-Organe sind unvollständig ohne Blutgefässe. Um eine echte Vergleichbarkeit mit lebenden Organismen sicherzustellen, muss man ein lebensnahes Netz winziger durchflussfähiger Blutgefässe und Kapillaren erzeugen – und zwar auf genau kontrollierbare, reproduzierbare Weise. Genau das ist an der Technischen Universität Wien jetzt gelungen: Forschende entwickelten ein neues Verfahren, bei dem mit Hilfe ultrakurzer Laserpulse in kurzer Zeit auf reproduzierbare Weise winzige Blutgefässe entstehen. Versuche zeigen: Diese Gefässe verhalten sich tatsächlich so wie Gefässe im lebenden Gewebe. Leber-Gewebe wurde mit grossem Erfolg auf einem Chip hergestellt.
Echte Zellen in künstlichen Kanälchen
«Wenn man beispielsweise untersuchen möchte, wie bestimmte Medikamente in unterschiedlichen Geweben transportiert und absorbiert werden, dann braucht man feinste Netze aus Blutgefässen», sagt Alice Salvadori, die in der Arbeitsgruppe von Prof. Aleksandr Ovsianikov am Institut für Werkstoffwissenschaft und Werkstofftechnologie der TU Wien forscht.
Idealerweise werden solche Blutgefässe in speziellen Materialien hergestellt, in sogenannten Hydrogelen. Diese Materialien bieten den lebenden Zellen Halt, sind aber durchlässig, ähnlich wie natürliche Gewebe. Wenn man in solchen Hydrogelen kleine Kanälchen erzeugt, kann man erreichen, dass sich im Inneren dieser Kanälchen sogenannte Endothelzellen anlagern – Zellen, die in unserem Körper das Innere von Blutgefässen auskleiden. Damit hat man ein künstliches Modell erzeugt, das einem lebenden Blutgefäss sehr ähnlich ist.
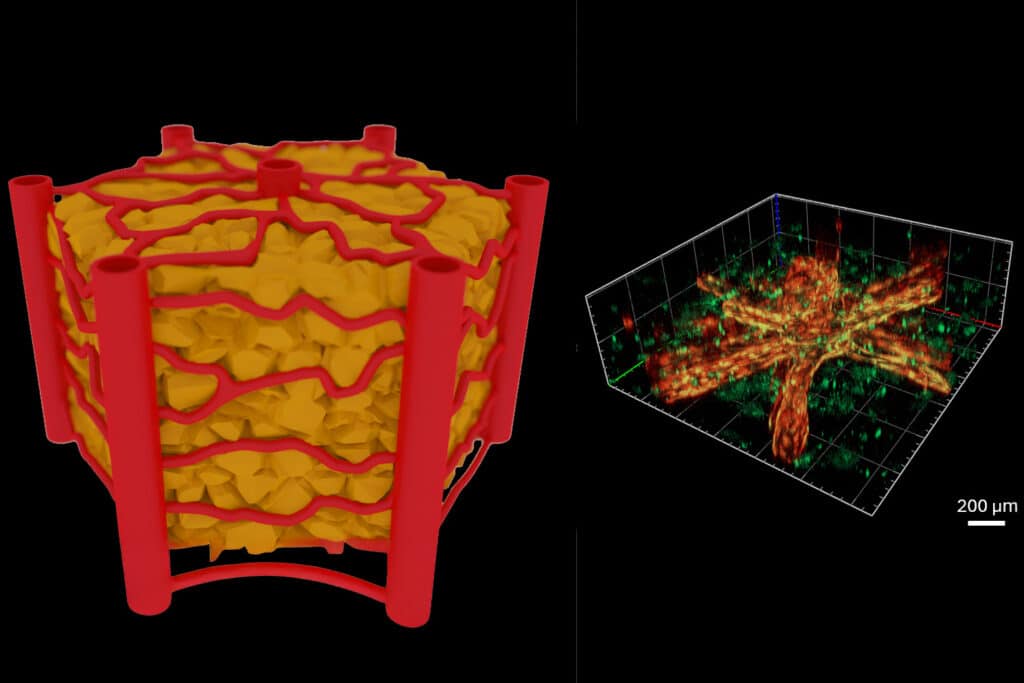
Die grosse Schwierigkeit dabei ist allerdings: Form und Grösse solcher Blutgefäss-Netzwerke sind schwer zu kontrollieren. Wenn die Netzwerke sich frei entwickeln, variiert die Geometrie der Blutgefässe immer stark von einer Probe zur anderen. Damit lassen sich keine reproduzierbaren, exakten Experimente durchführen – doch gerade das ist für präzise medizinische Forschung wichtig.
Besseres Hydrogel und Laser-Präzision
An der TU Wien setzte man daher auf eine hochentwickelte Lasertechnik: Mit Hilfe ultrakurzer Laserpulse mit einer Dauer im Femtosekunden-Bereich kann man in Hydrogelen sehr schnell und sehr effizient hochpräzise 3-D-Strukturen in das Material hineinschreiben.
«Wir können auf diese Weise Kanäle herstellen, die nur hundert Mikrometer voneinander entfernt sind. Das ist essenziell, wenn man die natürliche Dichte von Blutgefässen in bestimmten Organen replizieren möchte», sagt Aleksandr Ovsianikov.
Doch nicht nur die exakte Herstellung der gewünschten Blutgefäss-Geometrie ist wichtig, die Blutgefäss-Netzwerke müssen vor allem stabil bleiben, wenn sie von Zellen besiedelt werden. «Wir wissen, dass Zellen ihre Umgebung verändern können. Das kann zu Verformungen führen, oder sogar zur Verstopfung von Blutgefässen», sagt Alice Salvadori. «Daher haben wir die Material-Präparation verbessert.»
«Wir haben eine skalierbare Technologie entwickelt, die im industriellen Massstab eingesetzt werden kann.» Prof. Aleksandr Ovsianikov, TU Wien
Anstelle des üblichen einstufigen Gelierungsverfahrens verwendete die Forschungsgruppe einen zweistufigen thermischen Härtungsprozess: Das Hydrogel wird in zwei Phasen mit unterschiedlichen Temperaturen erwärmt, nicht nur in einer. Dadurch verändert sich seine Netzwerkstruktur, und ein stabileres Material entsteht. Die Gefässe bleiben offen und behalten ihre Form über einen längeren Zeitraum bei.
«Wir haben nicht nur gezeigt, dass wir künstliche Blutgefässe herstellen können, die tatsächlich durchflossen werden können. Noch wichtiger ist: Wir haben eine skalierbare Technologie entwickelt, die im industriellen Massstab eingesetzt werden kann», sagt Aleksandr Ovsianikov. «Die Strukturierung von 30 Kanälen dauert nur 10 Minuten, was mindestens 60-mal schneller ist als andere Techniken.»
Entzündung am Chip: Blutgefässe verhalten sich natürlich
Wenn biologische Prozesse mit solchen Chips nachgestellt werden sollen, muss man zunächst sicherstellen, dass sie sich tatsächlich so verhalten wie natürliches Gewebe. Und das konnte das Team nun tatsächlich nachweisen: «Wir haben gezeigt, dass diese künstlichen Blutgefässe tatsächlich mit Endothelzellen besiedelt werden, die genauso reagieren wie Endothelzellen im Körper», sagt Alice Salvadori. «Sie reagieren beispielsweise auf dieselbe Weise auf Entzündungen – sie werden dabei durchlässiger, genau wie Blutgefässe im Körper.»
Damit ist nun ein wichtiger Schritt getan, die Lab-on-a-Chip-Technologie zum industriellen Standard in vielen Bereichen der medizinischen Forschung zu machen.

Grosser Erfolg mit Lebergewebe
«Mit diesem Ansatz konnten wir ein Lebermodell mit Blutgefässen ausstatten. In Zusammenarbeit mit der Keio-Universität in Tokyo haben wir ein Leberläppchen auf einem Chip entwickelt, das ein kontrolliertes 3-D-Gefässnetzwerk enthält, das die Anordnung der Zentralvene und Sinusoide in vivo genau nachahmt», sagt Aleksandr Ovsianikov.
«Die Nachbildung der dichten und komplexen Mikrogefässe der Leber war lange Zeit eine Herausforderung in der Organ-on-Chip-Forschung. Durch den Aufbau mehrerer Schichten von Mikrogefässen, die das gesamte Gewebevolumen durchziehen, konnten wir eine ausreichende Nährstoff- und Sauerstoffversorgung sicherstellen – was wiederum zu einer verbesserten Stoffwechselaktivität im Lebermodell führte. Wir glauben, dass diese Fortschritte uns einen Schritt näher an die Integration der Organ-on-a-Chip-Technologie in die präklinische Arzneimittelforschung bringen», sagt Masafumi Watanabe (Keio-Universität).
«Die Organ-on-a-Chip-Technologie und fortschrittliche Lasertechnologie lassen sich gut kombinieren, um zuverlässigere Modelle von Blutgefässen und Lebergewebe zu erstellen. Ein wichtiger Durchbruch ist die Möglichkeit, winzige Gewebe auf einem Chip zu bauen, durch die Flüssigkeit fliessen kann, ähnlich wie Blut im Körper. Dies hilft Forschenden, besser zu verstehen, wie der Blutfluss die Zellen beeinflusst. Die Organ-on-a-Chip-Technologie ermöglicht es auch, die Reaktionen der Zellen unter dem Mikroskop genau zu beobachten. Diese Modelle werden Wissenschaftlern helfen, die Funktionsweise des Körpers zu untersuchen, und könnten in Zukunft zu besseren Behandlungen und einer besseren Gesundheitsversorgung führen.» sagt Prof. Ryo Sudo, Keio-Universität.




