Dank Pionierarbeiten an der Universität Genf eröffnen extrem stabile chirale Moleküle mit einer neuartigen Struktur Pharma-Ingenieurinnen und Werkstoff-Ingenieuren weite Forschungsfelder.
Symmetrien spielen in der Natur eine wichtige Rolle. Zum Beispiel können Moleküle mit einem Asymmetriezentrum in zwei räumlichen Konfigurationen auftreten, die sich zueinander spiegelbildlich verhalten: Sie können, wie unsere rechte und linke Hand, nicht durch Drehung oder andere Verschiebungen im Raum zur Deckung gebracht werden. Daher kommt auch die Bezeichnung «chirales Molekül» – von chiral = händisch. Es gibt eine Rechts- und eine Links-Konfiguration (R und S).
Dieselbe Zusammensetzung – mal Heilmittel, mal Gift
Ein trauriges Beispiel für die Auswirkungen in biologischen Systemen stellt der Skandal um das Schlaf- und Beruhigungsmittel Contergan: Der enthaltene Wirkstoff Thalidomid besteht aus chiralen Molekülen. Moleküle in der einen Konfiguration weisen den gewünschten sedierenden Effekt auf, ihr Spiegelbild jedoch wirkt fruchtschädigend.
Tragischerweise vertrieb das deutsche Pharmaunternehmen Grünenthal, Stolberg, das Medikament zwischen 1957 und 1961 als Racemat (Gemisch aus beiden Konfigurationen) und noch dazu ursprünglich mit einer Empfehlung für Schwangere. Die Folgen zeigten sich an Missbildungen und fehlenden Gliedmassen bei Neugeborenen.
Prägnant lässt sich sagen: Bei chiralen Molekülen kann das eine Heilung bringen und das andere giftig sein. Bei der Entwicklung und Produktion von Arzneimitteln ist dies zu berücksichtigen. Da die beiden Konfigurationen eine identische chemische Zusammensetzung und (fast) dieselbe Struktur besitzen (bis auf den kleinen Unterschied in der räumlichen Anordnung der Atome), scheint auf den ersten Blick eine Trennung unmöglich, doch kann sie beispielsweise mit Hilfe chromatographischer Verfahren unter Verwendung von chiralen Säulenmaterialien gelingen.
Des Weiteren gilt es zu berücksichtigen, dass sich ein Molekül in der R-Konfiguration in ein Molekül der S-Konfiguration umwandeln kann. In Abhängigkeit von äusseren Parametern, zum Beispiel der Temperatur, kann dies in unterschiedlichen Zeitspannen erfolgen. Das hat Auswirkungen auf die Haltbarkeit eines entsprechenden Arzneimittels.
Ein Novum: nur Sauerstoff und Stickstoff um das chirale Zentrum
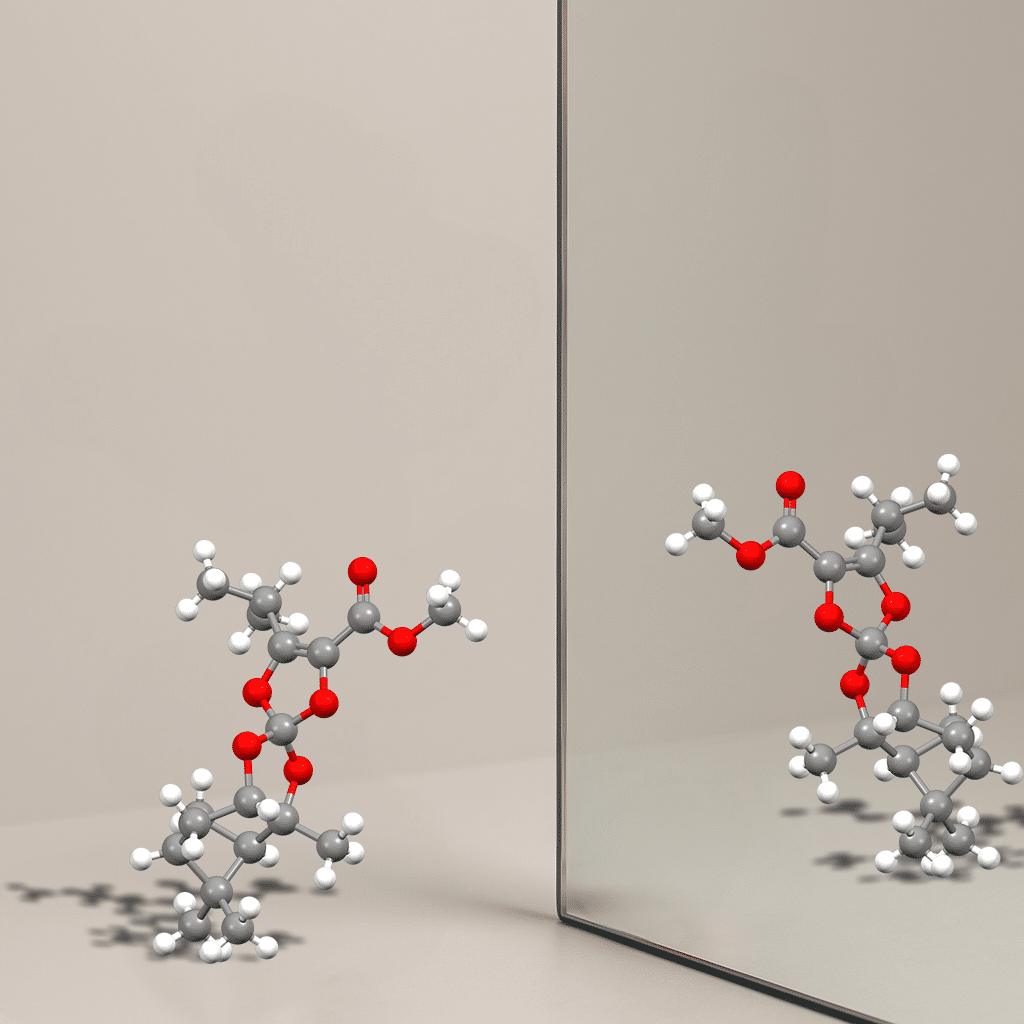
Das Asymmetriezentrum, das für die Chiralität verantwortlich ist, besteht in der Regel aus einem Kohlenstoffatom, das an unterschiedliche Reste gebunden ist, zum Beispiel an ein Wasserstoffatom, an Kohlenwasserstoffketten oder Ketten mit Heteroatomen (Sauerstoff, Stickstoff). Die Gruppe von Jérôme Lacour, ordentlicher Professor am Departement für organische Chemie der Abteilung für Chemie und Biochemie der naturwissenschaftlichen Fakultät der Universität Genf, hat nun einen neuen Typ von Asymmetriezentren designt. Dabei ist das zentrale Kohlenstoffatom nur von Sauerstoff- und Stickstoffatomen umgeben. Es handelt sich um Tetraoxa-Sprioverbindungen (vier Sauerstoffatome, Abb. 1) oder um Azatrioxa-Sprioverbindungen (ein Stickstoffatom und drei Sauerstoffatome).
«Moleküle mit dieser neuen Art von stereogenem Zentrum sind noch nie zuvor in stabiler dreidimensionaler Form isoliert worden. Ihre Synthese und Charakterisierung stellen einen bedeutenden konzeptionellen und experimentellen Fortschritt dar», erklärt Jérôme Lacour (Abb. 2) [1].

Die Molekülstrukturen mit Asymmetriezentren aus einem nur an Sauerstoff- und Stickstoffatome direkt gebundenen Kohlenstoffatom weisen eine aussergewöhnliche Stabilität auf. Die Umwandlung von einem Molekül in der R-Konfiguration in sein S-Spiegelbild findet in langen Zeiträumen statt.
Olivier Viudes, Doktorand und Erstautor der Studie, präzisiert: «Mit Hilfe von dynamischen Chromatographietechniken und quantenchemischen Berechnungen konnten wir abschätzen, dass es bei einem der entwickelten Moleküle bei Raumtemperatur 84.000 Jahre dauern würde, bis sich die Hälfte einer Probe in ihr Spiegel-Molekül umgewandelt hat.» Bei einem anderen kam man auf 227 Tage bei 25 °C. Das bedeutet für die Praxis der Pharmaforschung: Für ein Medikament garantiert eine solche Stabilität eine sichere Lagerung, ohne dass besondere Bedingungen (z.B. Kühlung bei Lagerung und Transport) erforderlich sind.
Die von dem Genfer Team entwickelten neuen stereogenen Zentren dürften das Design von dreidimensionalen, stabilen und kontrollierten chiralen Molekülen ermöglichen. Diese Strukturen eröffnen neue Möglichkeiten für die Entwicklung von Medikamenten oder Materialien.
«Es geht um eine neue Art, den molekularen Raum zu organisieren. Unsere stereogenen Zentren eröffnen einen völlig neuen Grad an Freiheit und Vorstellungskraft in der chemischen Synthese», betont Gennaro Pescitelli, Professor an der Universität Pisa und Hauptmitwirkender an diesem Artikel [2].
Vorgezeichnetes Vorgehen – Ansatzpunkte für die Forschung
Die Aufgabe für Pharma-Forschergruppen liegt damit auf der Hand: Da die Natur in vielfacher Hinsicht chiral organisiert ist (z.B. Aminosäuren, Zucker, DNA), kommen chirale Moleküle als Wirkstoffe grundsätzlich an vielen Stellen in Betracht. Das trifft insbesondere auf die neuartigen Kompositionen mit dem Asymmetriezentrum aus einem Kohlenstoff, umgeben von Sauerstoff und Stickstoff (sonst nichts!) als unmittelbare Bindungspartner, zu. Ist erst einmal ein solcher Wirkstoffkandidat identifiziert, bringt er automatisch einen grossen Vorteil mit: Um die Lagerfähigkeit braucht man sich wohl nicht zu sorgen, liegt die „Halbwertszeit“ doch im Bereich einer dreistelligen Anzahl von Tagen oder einer fünfstelligen Anzahl von Jahren.
Ähnlich verhält es sich in der Materialforschung: Ein Material mit genialen neuen Eigenschaften und mit dem besagten neuartigen Asymmetriezentrum brächte quasi von Natur aus eine hohe Langzeitstabilität mit. Zu den lohnenswerten Forschungsfeldern sollten ganz allgemein Werkstoffe mit richtungsabhängigen Eigenschaften gehören, wie zum Beispiel Flüssigkristalle, oder stationäre Phasen für die Chromatographie (stereoselektive Trennungen, s.o.).
Auch prädestinieren ihre lichtoptischen Eigenschaften (Drehung der Ebene polarisierten Lichts) langzeitstabile chirale Verbindungen für eine Reihe von Spezialaufgaben. Zu ihnen könnten der Einsatz in extrem scharf sichtbaren Displays oder, umgekehrt, in besonders schlecht identifizierbaren Tarnmaterialien, in Sensoren zur Bestimmung chemischer und biologischer Kampfstoffe oder bei der Verschlüsselung von Daten zählen.
Zugegeben: Das ist zurzeit zum großen Teil noch etwas spekulativ. Wo aber heute Universitäten, andere Forschungsinstitute und Unternehmen auf den Zug der neuartigen Chiralität aufspringen, könnten morgen ungeahnte Früchte zu ernten sein.
Dr. Christian Ehrensberger
Literatur
1. Une nouvelle architecture au coeur des molécules. Pressemitteilung der Universität Genf vom 15. Juli 2025. https://www.unige.ch/medias/2025/cdp-lacour
2. Olivier Viudes, Céline Besnard, Alexander F. Siegle, Oliver Trapp, Thomas Bürgi, Gennaro Pescitelli, Jérôme Lacour: All-Heteroatom-Substituted Carbon Spiro Stereocenters: Synthesis, Resolution, Enantiomeric Stability, and Absolute Configuration. J Am Chem Soc 2025; 147(24): 21121–21130. doi: 10.1021/jacs.5c06394