Die Menschheit hat einen unstillbaren Hunger nach Ammoniak: Aus diesem Stoff wird Dünger gemacht, der wiederum in der modernen Landwirtschaft verwendet wird. Bislang ist das Haber-Bosch-Verfahren das Mittel der Wahl, um der schier unerschöpflichen Lufthülle Stickstoff zu entziehen und in Form von Ammoniak zu binden. Dieser Weg braucht jedoch extrem viel Methangas und Energie. Forschende haben jetzt eine klimafreundlichere Alternative entdeckt, mit der sich Ammoniak aus regenerativen Energiequellen herstellen lässt.
Wie im Garten Eden: Getreide, Rüben und Kartoffeln sollen möglichst üppig spriessen, damit die Teller gut gefüllt sind. Dafür sorgt regelmässige Düngung – vor allem mit Stickstoff. Ein Nährelementquell, der scheinbar nie versiegt. Anfang des 20. Jahrhunderts entwickelten Fritz Haber und Carl Bosch ein Verfahren, das Stickstoff aus der schier unerschöpflichen Luft gewinnt. Für diese Leistung gab es 1918 den Nobelpreis für Chemie.
Mit einem eisenhaltigen Katalysator, sehr hohem Druck und Temperaturen von bis zu 500 Grad Celsius bindet das Haber-Bosch-Verfahren Stickstoff aus der Luft an Wasserstoff, wodurch Ammoniak entsteht. Nur am Rande: Auch einige Pflanzen beherrschen die Kunst, mit winzigen Bakterien in ihren Wurzeln Luftstickstoff zu binden und für ihr Wachstum verfügbar zu machen. Allerdings schaffen dies die grünen Gewächse klimaneutral, der Mensch bislang nicht.
«Das Haber-Bosch-Verfahren ist extrem energieaufwendig», sagt Prof. Dr. Nikolay Kornienko vom Institut für Anorganische Chemie der Universität Bonn. Grundlage für die Ammoniak-Gewinnung sind ganz überwiegend fossile Energieträger – entsprechend gross ist der Ausstoss am Treibhausgasen. «Um das Ziel einer nachhaltigen und klimaneutralen Gesellschaft zu erreichen, ist die Suche nach alternativen Ammoniak-Synthese-Prozessen prioritär», sagt Kornienko, der auch Mitglied im Transdisziplinären Forschungsbereich «Matter» der Universität Bonn ist.
Stickstoffdünger aus Sonne und Wind
Alternative Methoden? Daran wird schon länger experimentiert. Ziel ist es, die Haber-Bosch-Ammoniaksynthese durch ein Verfahren zu ersetzen, das mit regenerativer Energie etwa aus Sonne und Wind arbeitet. Der erforderliche Wasserstoff stammt dann nicht mehr aus dem Methangas, sondern wird direkt aus der elektrischen Spaltung von Wasser (H2O) in Wasserstoff (H2) und Sauerstoff (O2) gewonnen. Klingt einfach? Ist es aber nicht. Wer Ammoniak mithilfe von Wind und Sonne in grossem Massstab produzieren will, muss in den chemischen Reaktionswegen etliche Klippen umschiffen.
Strom Ammoniak zu erzeugen. (Bild: Nikolay Kornienko)
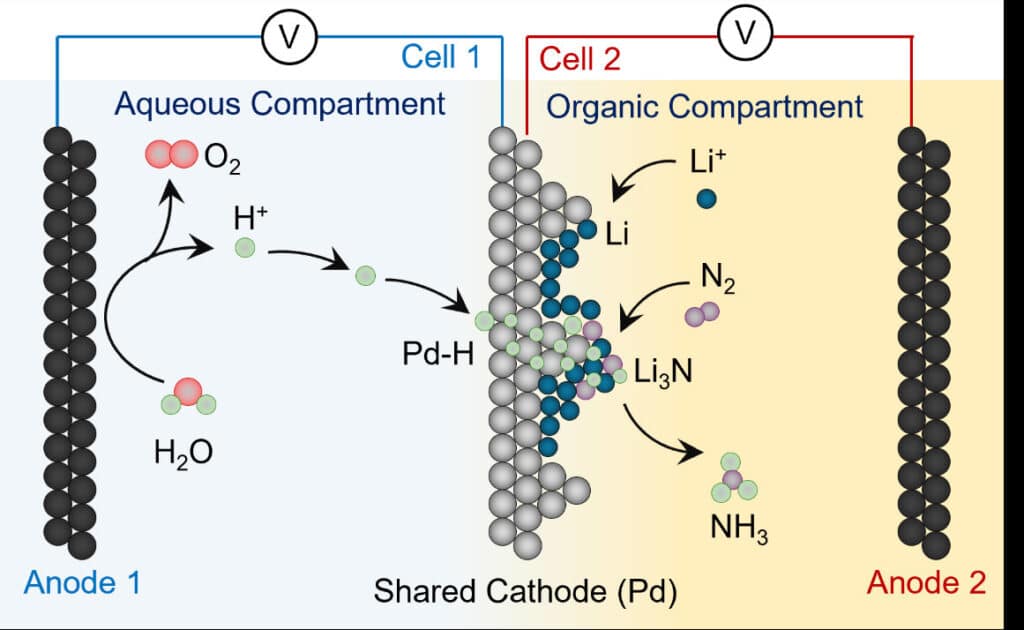
«Die Lithium-vermittelte Stickstoffreduktionsreaktion (LiNRR) gilt als der robusteste Weg zur Elektrifizierung der Ammoniak-Synthese», sagt Hossein Bemana, der Hauptautor der Studie. In diesem System werden Lithium-Ionen (Li+) elektrochemisch zu einer Lithium-Metallschicht reduziert. Dieses Lithiummetall kann dann mit Stickstoffgas (N2) reagieren und eine Lithium-Stickstoff-Verbindung bilden. Wenn eine Wasserstoffquelle vorhanden ist, wird die Lithium-Stickstoff-Verbindung in Ammoniak (NH3) und gelöste Lithium-Ionen umgewandelt. Dann geht es wieder von vorne los, und der Prozess kann von neuem beginnen. Soweit die Theorie.
Ausserdem: Gepulste Elektrolyse
Neben dem energieintensiven Haber-Bosch-Verfahren belasten auch Düngemittelrückstände Böden und Gewässer. Zudem trägt Distickstoffmonoxid, ein Nebenprodukt der Stickstoffchemie, erheblich zum Klimawandel bei: Sein Treibhauspotenzial ist rund 300-mal höher als das von Kohlendioxid. Die gepulste Elektrolyse könnte hier eine nachhaltige Alternative bieten. Das neuartige Verfahren nutzt überschüssigen Stickstoff aus Luft und Wasser als Ausgangsstoff und ermöglicht so die energieeffiziente Herstellung wertvoller Verbindungen wie Ammoniak und Harnstoff. Forschende an der Johannes Gutenberg-Universität Mainz haben deshalb hierzu alle verfügbaren Studien zusammengetragen, um eine Grundlage für künftige Arbeiten zu schaffen.
www.uni-mainz.de
«Generell sehen wir dieses System vorerst als Modell an, da mehrere praktische Schwierigkeiten bestehen», sagt Kornienko. Weil eine hohe Spannung erforderlich ist, um Lithiumionen zu metallischem Lithium zu reduzieren, ist der Energiewirkungsgrad auf etwa 25 Prozent begrenzt. Ausserdem muss das System in einer luft- und wasserfreien Umgebung arbeiten, da Lithiummetall sehr reaktiv ist. Eine weitere Herausforderung ist, dass ähnlich wie in Batterien auf der Lithiumschicht eine poröse Festelektrolyt-Grenzschicht (Solid Electrolyte Interphase, abgekürzt: SEI) wächst. Diese Schicht muss den Durchgang von Stickstoffgas und Wasserstoff als Reaktanten zum
Lithium ermöglichen.
Das Falsche wird geopfert
Im Idealfall würde der Wasserstoff direkt aus der Spaltung von Wasser stammen. Doch werden in diesem System in der Regel Alkohole als Wasserstoffquelle verwendet. Teils zersetzt sich auch das Lösungsmittel und dient dann selbst als Wasserstoffquelle. «Dies macht das System unpraktisch, da mehrere Alkohol- oder Lösungsmittelmoleküle geopfert werden müssen, um ein Ammonium herzustellen», sagt der Chemiker.
Jedoch haben die Forschenden einen Weg gefunden, wie sich der Wasserstoff direkt aus der Spaltung von Wasser gewinnen und auf Stickstoff übertragen lässt. Sie haben eine Palladiumfolie (Pd) als Elektrode und gleichzeitig als Membran verwendet. «Palladium kann als Membran dienen, weil es Wasserstoffatome durchzulässt», berichtet Kornienko. Im Experiment trennte die Pd-Folie eine wasserfreie Reaktionsumgebung, in
der die LiNRR-Reaktionen ablaufen, von einer Reaktionsumgebung auf Wasserbasis. «Am Ende konnten wir Wasserstoffatome elektrochemisch direkt aus dem Wasser entnehmen und auf das reaktive Lithium/Lithium-Stickstoff-Material übertragen, um Ammoniak herzustellen», sagt der Chemiker.
Ammoniak beeinträchtigt empfindliche Ökosysteme
Ammoniak trägt in der Schweiz von allen reaktiven Stickstoffverbindungen anteilsmässig am meisten zur Stickstoffbelastung in empfindlichen Ökosystemen bei. Damit ist NH3 wesentlich für die Überdüngung und Versauerung solcher Systeme verantwortlich. Zu diesen empfindlichen Ökosystemen gehören u.a. Wälder, Hoch- und Flachmoore, artenreiche Naturwiesen und Heidelandschaften. NH3 trägt aber auch zur Bildung von sekundärem Feinstaub bei. Feinstaub hat grosse negative Auswirkungen auf die menschliche Gesundheit. Der Handlungsbedarf zur Minderung der NH3-Belastung in der Schweiz ist gross, weshalb die Belastungssituation und deren Entwicklung immissionsseitig vom Bafu bzw. der Forschungsstelle für Umweltbeobachtung (www.fub-ag.ch) überwacht wird. Gemäss dem «Messbericht Ammoniak-Immissionsmessungen in der Schweiz 2000 bis 2024» wurden die höchsten Konzentrationen und stärksten jahreszeitlichen Schwankungen in Gebieten mit intensiver Tierproduktion gemessen, wo die Jahresmittel Werte von 6–12 μg m-3 erreichten.
ChemieXtra
Dass dies wirklich so funktioniert wie gewünscht, haben die Forschenden mit Infrarotspektroskopie und Massenspektrometrie nachgewiesen. Sie verwendeten ein schweres Isotop des Wassersstoffs (Deuterium = D) als Wasserquelle und stellten damit ND3 statt NH3 her. Umgekehrt markierten die Forschenden alle Moleküle im LiNRR-Kompartiment mit D anstelle von H – wie gewünscht entstand in diesem Fall NH3 und nicht wie zuvor ND3.
Weiter Weg zu wirtschaftlich rentabler Herstellung
Hossein Bemana und Nikolay Kornienko haben zu diesem Verfahren bereits ein Patent angemeldet. Das Forschungsteam verwendete für seine Experimente zur Erzeugung von Ammoniak (NH3) nur elektrischen Strom. Allerdings ist es noch ein weiter Weg, bis sich der gewünschte Stickstoffdünger aus erneuerbaren Energiequellen wirtschaftlich rentabel herstellen lässt. Hierfür müssten die Wissenschaftler etwa die 1000-fache Ausbeute im Vergleich zu ihren aktuellen Experimenten erreichen. «Wir befinden uns noch in der Anfangsphase», sagt der Chemiker. «Generell muss an den Reaktionsgeschwindigkeiten und der Selektivität des Systems – der Steuerung der Elektronen zum gewünschten Ziel – geforscht werden.» Die Forschungsgruppe hat seine Ergebnisse in der Fachzeitschrift Nature Communications vorgestellt.




